При какой температуре замерзает вода – самая полная информация!
Большинство людей уверены, что знают, при какой температуре замерзает вода – ниже 0 градусов по шкале Цельсия. Однако так случается далеко не всегда. Не верите? Тогда читайте нашу статью – в ней мы подробно рассмотрим различные условия.
Пресные водоемы
В любых пресных водоемах, в том числе в реках, вода замерзает при температуре в 0 градусов. Например, самые чистые ручьи и небольшие речки промерзать начинают … с дна! Первоначально ледовый налет образовывается на корягах и прочих присутствующих в воде растениях и предметах. А когда этот ледовый налет поднимается наверх, река водоем сразу же замерзает.
Дистиллированная вода
Дистиллированная вода являет собой жидкость, прошедшую особую очистку. В ней нет никаких примесей, а также полностью отсутствуют так называемые ядра кристаллизации, которые и обеспечивают замерзание.
Поэтому образование льда в дистиллированной воде происходит при довольно низких температурах – лишь, когда столбик термометра опускается к отметке в -42 градуса.
Хотя исследователям удалось добиться такого уровня дистилляция, что полученная жидкость не замерзала до того момента, пока температура не достигла отметки в -70 градусов.
Кстати, такая жидкость, которая охлаждена до крайне низких температур, но так и не замерзла, получила название переохлажденной.
Замерзание соленой воды
Многие интересуются, при какой температуре замерзает морская вода, ведь в ней присутствует большое количество соли.
Итак, уровень температуры соленой воды, при которой она начнет замерзать, составляет не более -1,9 градусов.
Кстати, знаете ли вы, что используется специальная соль для очистки воды? Она засыпается в особые виды фильтров.
В результате исследований было установлено, что средняя температура замерзания морей планеты составляет -4 градуса по Цельсию. Однако этот показатель непостоянный – в разных морях он разный, что обусловлено не только уровнем содержания соли, но и прочими факторами:
- Каспий начинает замерзать, если температура опустится всего лишь на полградуса ниже нулевой отметки;
- Азовское море покрывается льдом, если температура воды опустится до отметки в -0,7 градуса.
 Лед сковывает воды Азова примерно с конца декабря и по начало марта. В некоторых местах толщина ледового покрытия достигает одного метра;
Лед сковывает воды Азова примерно с конца декабря и по начало марта. В некоторых местах толщина ледового покрытия достигает одного метра; - Японское море вообще не замерзает, что обусловлено повышенным содержанием соли – этот уровень равняется 34 промилле;
- Балтийское море имеет наименьшее содержание соли из всех вышеперечисленных морей и замерзает при охлаждении воды до 0 градусов.
Как видите, далеко не всегда вода замерзает при температуре в 0 градусов – возможны и исключения. Которые, кстати, не редкие!
А чтобы получать дома чистую и приятную воду дома, рекомендуем установить системы обратного осмоса.
при якій температурі замерзає океанічна вода
поезд двигался по меридиану с севера на юг 7 часов . Сколько градусов составило вращения земли с запада на восток за это время
демографічні процеси. система розселення. найбільші міста. українська діаспора. Чорногорія
Решите пожалуйста, срочно надо
Составьте свои 4 вопроса к тексту «Многолетняя мерзлота». Вопросы №1-2 (простые) должны начинаться с вопросительных слов «Какие? Сколько? Почему? Где?
Вопросы №1-2 (простые) должны начинаться с вопросительных слов «Какие? Сколько? Почему? Где?
…
Как? и т.п.» Вопросы №3-4 (сложные) должны начинаться со слов «Зачем? Из чего состоит? Каким образом? Если сравнить? Назовите две причины и т.п
особливості економіко географічного положення Чорногорії
Какие факторы обусловили развитие в Канаде деревообработки и целлюлозно-бумажной промышленности
Составьте свои 4 вопроса к каждому тексту « Озера Евразии» и «Многолетняя мерзлота». Вопросы №1-2 (простые) должны начинаться с вопросительных слов «К
…
акие? Сколько? Почему? Где? Как? и т.п.» Вопросы №3-4 (сложные) должны начинаться со слов «Зачем? Из чего состоит? Каким образом? Если сравнить? Назовите две причины и т.п
Помогите срочно география 8 класс
ДАЮ 74 БАЛЛА
География Вологодской области.
I. По плану составьте характеристику ЭГП области.
План 1. Положение в пределах страны, федеративных округ
…
ов, экономических районов.
2. Соседское положение, положение относительно столиц.
3.Положение относительно топливных и сырьевых баз вне области
4.Транспортное положение области, важнейшие транспортные пути федерального, межрегионального значения.
5.Положение по отношению к морям. 6.Выводы о выгодном (невыгодном) положении. (+ и -)
II. Составьте маршрут туристического путешествия по Вологодчине ( не менее 5 пунктов).
Укажите, что можно увидеть интересного в каждом пункте, вид транспорта. Можно составить схему путешествия с небольшим описанием
ПОМОГИТЕ ПЖЖЖ
(Место Казахстана в международном сопоставлении стран мира)
нужно вопросы по этой теме примерно 10 вопросов
Дистильована вода | Вода дистильована
Дистильована вода
Артикул:
451684845
24,30
грн.
Кількість:
Дистильована вода ГОСТ 6709-72 — очищена вода, практично не містить домішок і сторонніх включень. Одержують перегонкою в спеціальних апаратах — дистилляторах. Дистильована вода — це чиста Н2О, або вода з мізерно малими домішками сторонніх речовин. Використовується вона в основному для медичних або дослідницьких цілей. Її виробляють в спеціальних дистилляторах шляхом випарювання звичайної прісної води з подальшою конденсацією пара — дистиляцією. При цьому всі присутні у воді домішки залишаються в випарене залишку. Цей процес заснований на принципі, що вода є летюча речовина, а солі є нелетучими речовинами. Також надходять з морською водою, щоб позбавити її від солей і мінеральних включень.
При цьому всі присутні у воді домішки залишаються в випарене залишку. Цей процес заснований на принципі, що вода є летюча речовина, а солі є нелетучими речовинами. Також надходять з морською водою, щоб позбавити її від солей і мінеральних включень.
Питома електропровідність дистильованої води, як правило, менше 5 мкСм / см. При необхідності використання більш чистої води використовують деіонізовану воду. Питома електропровідність деионизованной води може бути менше 0,05 мкСм / см. Дистильована вода не кристалізується при температурі нижче 0 ° C без поштовху (струшування) і кипить при температурі вище 110 ° C.
Дистильовану воду використовують для коригування щільності електроліту, безпечної експлуатації акумулятора, промивання системи охолодження, розведення концентратів охолоджуючих рідин і для інших побутових потреб. Наприклад для додавання в парові праски (повністю виключають появу накипу), для коригування температури замерзання незамерзаючої склоомиваючої рідини і при кольорового фотодруку.
Цікаве про воду | КП «Вододар» Бориславської міської ради
Вчені відкрили спосіб дешевшого і ефективнішого опріснення води
Видалення солі з морської води, щоб зробити її безпечною для пиття, означає подолання ряду наукових проблем, включаючи оптимізацію мембрани, використовуваної для процесу опріснення, – і нові дослідження цих мембран обіцяють зробити всю операцію дешевше і доступнішою в майбутньому.
Вчені придумали спосіб потенційно зробити мембрани на 30-40 відсотків більше ефективними з точки зору енергії, необхідної для фільтрації води. Ключ до їх підходу криється в щільності мембран на нанорозмірному рівні. У новому дослідженні команда показує, що збереження постійної щільності мембран важливіше, ніж товщина самої мембрани. Це може поліпшити метод очищення води, відомий як зворотний осмос, при якому мінерали уловлюються і видаляються мембраною шляхом тиску.
Щоб отримати чіткіше уявлення про ці мембрани, Маніш Кумар з Техаського університету в Остіні і його колеги використовували метод мультимодальної електронної мікроскопії, що поєднує аналіз хімічного складу з 3D-картируванням на наномасштабному рівні, щоб змоделювати, наскільки ефективно можна очищувати воду.
Дослідження було викликано спостереженням, що товщі мембрани часто краще справлялися з опріснюванням, що суперечить інтуїції, враховуючи, що вода може проштовхнути більше матеріалу. Моделювання показало, що невідповідності і «мертві зони» в мембрані відіграють важливішу роль, ніж товщина.
На думку дослідників, щільність мембран буде рівномірно розподілена, і можна буде очистити більше води з меншими витратами енергії, що дозволить заощадити гроші як для великих корпорацій, так і для дрібних споживачів, а також забезпечити ширший доступ до технологій.
Виробництво прісної води життєво важливо не тільки для здоров’я населення, а й для використання в сільському господарстві та виробництві енергії. Щорічно очищаються мільярди галонів води, тому підвищення ефективності на 30-40 відсотків може мати величезне значення. Існує безліч способів очищення солоної води для використання в інших цілях, але мембранний підхід вже є одним з найефективніших. Наразі дослідники шукають способи подальшого поліпшення і налаштування для конкретних цілей.
Щорічно очищаються мільярди галонів води, тому підвищення ефективності на 30-40 відсотків може мати величезне значення. Існує безліч способів очищення солоної води для використання в інших цілях, але мембранний підхід вже є одним з найефективніших. Наразі дослідники шукають способи подальшого поліпшення і налаштування для конкретних цілей.
ЦІКАВІ ФАКТИ ПРО ВОДУ
Вчені вважають, що Україна може залишитися без води через глобальну катастрофу
21.07.2019
Світ вже давно стурбований швидкими темпами розвитку глобального потепління. З кожним роком в різних країнах висота температури повітря зростає. Вчені продовжують досліджувати аномалію і знаходити способи уникнути всесвітньої катастрофи.
З кожним роком в різних країнах висота температури повітря зростає. Вчені продовжують досліджувати аномалію і знаходити способи уникнути всесвітньої катастрофи.
Так вони припустили, що глобальне потепління спричинить за собою посуху по всій планеті. Ресурс води стане важко доступним, а потім і зовсім зникне, що призведе до тотальної смерті Землі і всього живого на ній.
Таку заяву зробили вчені з Потсдамського інституту. Вони також додали, що зростання населення ще більше погіршить ситуацію.
Дослідження показало, що якщо, наприклад, середня світова температура буде збільшуватися на два градуси Цельсія кожні 10 років, близько мільярда людей змушені будуть кинути своє місце проживання, оскільки вони взагалі залишаться без води.
За словами одного з експертів, найбільше глобальне потепління вдарить по центру Африки і південь Азії, а вже потім торкнеться північних регіонів. Невідомо, коли саме почнеться “водна криза”, однак ряд країн вже починають проводити деякі заходи щодо зменшення витрат води на людину. Губернатор Каліфорнії домагається підтримки з боку держави для захисту фермерських господарств від посухи.
Губернатор Каліфорнії домагається підтримки з боку держави для захисту фермерських господарств від посухи.
Для наочності вчені склали карту і виділили країни, де дефіцит води виявиться найбільш відчутним (вони виділені синім і блакитним кольором). Відзначимо, що Україна виявиться однією з тих країн, де буде більш відчутна нестача ресурсів води.
Вчені стверджують, що технології для ефективної витрати води вже придумані зараз. Більш того високорозвинені країни намагаються їх активно використовувати.
На допомогу також може прийти відкриття нових джерел води. Так, в червні вчені виявили один з найбільших запасів прісної води. На думку експертів, запаси могли утворитися 15-20 тисяч років тому. І хто знає, скільки джерел води ще є в світі, про які ми навіть не підозрюємо.
Але відзначається, що навіть запасів може не вистачити на всіх. Тому вчені закликають почати більш відповідально витрачати воду. Якщо не зробити цього зараз, в прямому сенсі вимре все людство.
Джерело
Багато хто думає, що про воду нічого нового ми вже не дізнаємося, проте вода одна з найбільш таємничих речовин і кожний день вчені відкривають цікаві та неймовірні факти. Всім відомо що вода — основа життя.
1. За підрахунками вчених інституту Вернадського, сумісно з вченими з Німеччини та Франції вік води на Землі понад 2.7 мільярди років.
2. Вода у нашій склянці могла впасти з неба всього декілька днів тому, але вона була свідком динозаврів та зародження життя.
3. Наша планета доволі замкнена система і схожа на величезний тераріум, який досить рідко втрачає або отримує нові речовини. Саме тому ми ніколи не матимемо більше води ніж сьогодні.
4. На Землі міститься понад 325 мільйонів кубічних миль, або 523 кубічних кілометри води.
5. Кожного року з поверхні земної кулі випаровується більше ніж 577 тисяч кілометрів кубічних води.
quote Більша частина айсбергу прихована під водою
7. До складу мантії Землі входить в десять разів більше води ніж у всіх океанах.
8. Понад 70% поверхні Землі покрито водою, але придатною для пиття є не більше 2%.
9. Основний запас прісної води заморожений у льодовиках.
10. Цікавим є також факт, що тихий океан менш солоний ніж Атлантичний.
11. 46.1% води світового океану міститься в Тихому, 29.9% в Атлантичному, 20.3% в Індійському та 3.7% в Північному Льодовитому океані.
12. Запаси льоду на Землі до 30 мільйонів кубічних кілометрів і більшість зберігається в полярних шапках.
13. Середня температура на поверхні океанів 17.4 градуси.
quote Маріанська западина — найглибше місце на Землі
14. Якщо кинути залізну кульку в Маріанську западину (глибина 11 022 ± 40 м) їй буде потрібно більше ніж годину часу, щоб досягти дна.
15. Морська вода багата на поживні речовини, в сантиметрі кубічному може міститись до півтора грама білка.
16. Якщо розтопити всі льодовики на нашій планеті то понад 12% суші зникне під водою, а рівень води у світовому океані підніметься на 65 м. 23 (10 в 23 степені) молекул.
23 (10 в 23 степені) молекул.
21. Вода дуже хороший розчинник і тому в абсолютно чистому вигляді в природі не трапляється.
22. Тільки вода в природі є у трьох станах : твердій (лід), рідкої та газоподібний.
23. Вчені виділяють понад 1300 видів води. Розрізняють воду за походженням (ґрунтова, льодовикова, джерельна, дощова), а також за розчиненими у ній речовинами.
24. Вода з вищою температурою замерзає швидше за холодну.
25. Гасити пожежі більш ефективно гарячою водою.
quote Пошкодження пляшки через розширення льоду
26. Коли вода замерзає вона розширяється до 9%, це часто стає причиною пошкодження труб і тари де вона зберігається.
27. Холодна вода губкою поглинається більше ніж гаряча.
28. В п’ять разів швидше поширюється звук у воді ніж у повітрі.
29. Доведено що при нагріванні дистильованої води у мікрохвильовій печі з’являється ймовірність її вибуху. Це пов’язане з тим, що дистильовану воду можна нагріти вище за температуру кипіння.
30. Морська вода замерзає при температурі — 1,91 ° C.
31. При дослідженні нових планет, в першу чергу вчені шукають воду.
32. На Юпітері погода як і на Землі залежить від кругообігу води в атмосфері.
33. Вчені знайшли лід на інших планетах Сонячної системи, також повністю льодом вкритий супутник Юпітера — Європа.
34. Наявність льоду фіксують у ядрах більшості комет. На основі цього факту ґрунтується припущення позаземного походження життя на Землі.
35. Життя на Землі появилося у воді.
quote Температура води в озері
36. Вода на відміну від більшості рідин замерзає не рівномірно, а зверху вниз, що надає можливість водним організмам вижити навіть у холодну пору року.
37. Без води не можливе існування білка, який переважно є основою більшості живих організмів.
38. Най необхіднішою для людини після кисню для виживання є вода.
39. Вода в клітині тіла людини є своєрідним генератором електричної та магнітної енергії.
40. Вода — універсальний та один з най розповсюдженіших розчинників на Землі. Вона транспортує всі корисні речовини які потрапляють до організму людини з їжею, а також виводить з тіла шкідливі та отруйні речовини.
Вона транспортує всі корисні речовини які потрапляють до організму людини з їжею, а також виводить з тіла шкідливі та отруйні речовини.
41. Людина на 60-80% складається з води і насамперед це залежить від віку. До прикладу людський ембріон на 90%, новонароджена дитина близько 80%, доросла людина до 65%. З віком людина втрачає воду, що є однією з причин біологічної старості.
42. Наша кров на 83% це вода.
quote Кількість води в тілі залежно від віку людини
43. Як не дивно, але наш мозок це також на 90-95% вода. Як правило він відчує зневоднення в першу чергу, симптомами є головний біль і розумове виснаження.
44. В хребті вода слугує своєрідним амортизатором і забезпечує його гнучкість та пружність.
45. Ми відчуємо спрагу вже при втраті 1% води.
46. При втраті двох відсотків на 20% зменшується наша фізична і розумова здатність.
47. Якщо втрата води близька до 10% починаються зорові та слухові галюцинації. Переважно втратою води пояснюється феномен міражів у пустелях.
48. При втраті понад 12-13% води в організмі, без лікарського втручання, людина може загинути.
49. Втрата 20% рідини для людини смертельна.
50. Залежно від кліматичних умов людина може обходитись без їжі до двох тижнів, проте без води не можна прожити менш як тиждень.
51. При перетравленні білкової їжі людиною також використовується вода, тому в екстремальних ситуаціях при відсутності доступу до води від м’яса краще відмовитись.
52. На зневоднення організм реагує так само як і на стрес, тобто мобілізуються резерви тіла, що викликає справжній стрес.
53. Переважно ми потребуємо півтора — два літри води на добу.
quote Кількість води, яку випиває людина за життя
54. За життя, в середньому, людина може випити до 40 т води.
55. Вода у великій кількості може і нашкодити, якщо за короткий час випити велику кількість води то вона може спричинити водний дисбаланс у мозку.
56. Вода є основою терморегуляції в організмі людини. Вона бере участь як в охолодженні так і при обігріві тіла.
57. Правильне вживання води понижує ймовірність серцевого нападу та добре впливає на серцево-судинну систему.
58. Голод і спрага — дуже схожі сигнали для мозку. Дуже часто коли ми відчуємо голод насправді організму потрібна вода.
59. Якщо випити води до вживання їжі, апетит суттєво понижується.
60. За перероблення жирів в нашому організмі відповідає печінка і часто, при зневодненні, вона не може повноцінно справлятись зі своєю основною роботою, в результаті чого починає відкладатися жир.
61. Всі біохімічні реакції в людському організмі проходять у водному розчині.
quote Кількість води в різних органах людини
62. За добу ми виділяємо таку кількість тепла, що можна б було закип’ятити понад тридцять літрів води.
63. При використанні водопровідної води, протягом життя, через організм проходить 80-100 кілограмі хімічних забрудників.
64. Кофеїн та алкоголь викликають збезводнення. Саме тому після великої кількості випитого алкоголю наступного дня болить голова і відчується спрага — це симптоми зневоднення.
65. Якщо замінити звичайну воду дистильованою то після тривалого вживання виникає дефіцит мінералі в організмі.
66. Хімічний і бактеріологічний стан води напряму впливає на здоров’я населення.
67. Понад 80% хвороб у світі передаються через воду.
68. Хвороби, які передаються за участі води, кожного року стають причиною смерті більше ніж 25 мільйонів людей.
69. За даними ВООЗ, через неякісну воду кожні вісім секунд у світі помирає людина.
70. В середньовіччі людина використовувала до п’яти літрів води на добу, що у двадцять разів менше від сучасної людини.
71. Близько 75% води ми використовуємо у ванній кімнаті, 5% використовуємо на кухні.
72. Більшість людей за добу використовує до ста літрів води в день. Найбільша кількість витраченої води припадає на змив в туалеті.
quote Діаграма використання води в побуті
73. 22 березня святкується День водних ресурсів.
74. В Азербайджані є джерело з величезним складом метану і вода з цього джерела в буквальному сенсі горить синім полум’ям.
75. На території Антарктиди є озеро з солоністю в одинадцять разів вищою ніж морська, завдяки цьому вода у ньому замерзає лише при температурі близькій до -50 С.
76. В продажі перша пляшка води з’явилась у 1767 році. Підприємець який додумався продавати газовану воду — англієць Джозеф Прістл.
77. В Сполучених Штатах Америки в продажі більше ніж вісімсот найменувань води.
78. У вісімнадцятому столітті в Каліфорнії вартість склянки води сягала ста доларів.
79. В Кенії вартість води в десять разів вища ніж у Нью-Йорку.
80. Найкраща вода за дослідженнями ЮНЕСКО у Фінляндії.
81. Нині понад мільярд людей на Землі не мають можливості користуватись безпечною для життя і здоров’я водою.
82. Найбільш вразливі підземні води, вони очищуються декілька тисячоліть.
85. Не рекомендовано кип’ятити воду двічі оскільки у воді виділяється діоксин — отрута яка провокує рак. У кип’яченій воді пиво охолоне швидше ніж у звичайній.
quote Кругообіг води у природі
85. Після випаровування вода перебуває у повітрі до десяти днів, поки знову впаде у вигляді опадів.
Після випаровування вода перебуває у повітрі до десяти днів, поки знову впаде у вигляді опадів.
86. Рух води у природі за 24 години виробляє енергії більше ніж використало людство за своє існування.
87. Дощова вода може містити вітамін В12.
88. Потужна гроза за 10 хвилин проливає на землю понад 60 мільйонів літрів води.
89. Рекорд по затримуванню дихання під водою 22 хвилини 22 секунди. Рекордсмен німецький дайвер Том Сітас.
90. В основі сучасного спорядження для занурення лежать винаходи Леонардо да Вінчі. Саме він винайшов перший апарат для підводного плавання.
91. На думку вчених, саме з високою якістю води пов’язане довголіття мешканців гірських регіонів. Вода високогірних струмків, як правило найкраща за своїм біохімічним складом.
92. Коли ми їмо кавун то практично п’ємо воду, оскільки він до 93% складається з води.
93. Як не дивно, такий на перший погляд, сухий фрукт як бананна понад 75% також складається з води.
94. Кожен харчовий продукт має свою водомісткість, тобто сумарний обсяг усіх видів води, необхідний для отримання продукту в кінцевому вигляді. Так, наприклад, водомісткість одного яблука становить близько 125 л, а кілограм шоколаду — 17 000 л.
Так, наприклад, водомісткість одного яблука становить близько 125 л, а кілограм шоколаду — 17 000 л.
quote Водомісткість продуктів харчування
95. Гілку першості серед тварин по вмісту води безумовно займає медуза, деякі види на 99% складаються з води.
96. Єдині ссавці з овальними еритроцитами це верблюди. Така особливість дає їм можливість безпечно переносити збезводнення. Тоді як круглі еритроцити людини при зневодненні починають злипатись і кров у буквальному сенсі гусне, у верблюдів еритроцити не злипаються і не змінюють в’язкість крові.
97. Дорослі верблюди можуть випити до двохсот літрів води за раз.
98. Всі звикли, що без води найдовше може прожити верблюд, однак навіть звичайні пацюки можуть довше обходитись без води.
99. Ігуана чудовий дайвер, оскільки може пробути під водою понад 25 хвилин.
100. Коали практично не п’ють, оскільки вони їдять виключно евкаліпт і потрібну їм вологу вони отримують з листя. До пиття звичайної води доходить лише під час засухи.
Як відчути себе чарівником — миттєва заморозка води
Хто з нас у дитинстві не захоплювався фокусами? Дитинство проходить, але віра в чудеса залишається. Нехитрі приготування, і ось ви вже творіть справжнє чаклунство. Трохи наукових знань, спритність рук і, головне, ніякого шахрайства. Пропонуємо вам взяти участь в експерименті, хід якого дуже простий.
Процес, який відображений на відео, називається миттєвою заморожуванням води. Для експерименту вам знадобиться очищена вода. Звичайно, дистильовану воду дістати проблематично, але для нашого випадку цілком підійде очищена питна вода, яка продається в магазині. Пів-літрову пляшку необхідно помістити в морозильну камеру, температура в якій близько -15 – 18 градусів. Коли через півтора-дві години ви дістанете пляшку, вода в ній як і раніше буде перебувати в рідкому стані, але її температура буде значно нижче нуля. Чому ж вона не замерзає? Вся справа в тому, що вона не містить в собі домішок, необхідних для кристалізації льоду і може знаходитися при температурі до мінус 40 градусів в рідкому стані. Тобто вона вже охолола і готова замерзнути, але у неї немає для цього відповідних центрів кристалізації, навколо яких відбувається утворення льоду.
Чому ж вона не замерзає? Вся справа в тому, що вона не містить в собі домішок, необхідних для кристалізації льоду і може знаходитися при температурі до мінус 40 градусів в рідкому стані. Тобто вона вже охолола і готова замерзнути, але у неї немає для цього відповідних центрів кристалізації, навколо яких відбувається утворення льоду.
А ось із звичайної прісної питної водою, що містить, як правило, розчинені солі, такий трюк не вийде. Вона почне замерзати вже в морозильній камері.
Але що ж відбувається, коли ми дістаємо пляшку з холоду? Як показано на відео, експериментатор струшує пляшку або доторкається до води шматочком льоду. Від механічного впливу або зіткнення з кристалами льоду переохлажденная вода починає прямо на очах перетворюватися на лід. Вода знаходить той самий відсутній центр кристалізації і, оскільки її температура значно нижче нуля градусів, запускається ланцюгова реакція — кристалики льоду лаштуються один до одного і поступово заповнюють собою весь обсяг пляшки.
Обов’язково спробуйте зробити таке зі своїми друзями або здивуйте дітей! Це дуже ефектний експеримент, а головне, легко здійсненний в домашніх умовах.
Замерзают ли аккумуляторы? Как влияют климатические условия на аккумулятор?
Да, аккумуляторы замерзают.
Температура замерзания полностью заряженного аккумулятора составляет от — 50 до -70 градусов. То ест. В обычных условиях заряженные аккумуляторы не замерзают. Однако, разряженные аккумуляторы, в зависимости от уровня разрядки могут замерзать даже при температуре от до -10 градусов. На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
Влияние погодных условий на аккумулятор:
Да, аккумуляторы замерзают.
Температура замерзания полностью заряженного аккумулятора составляет от — 50 до -70 градусов. То ест. В обычных условиях заряженные аккумуляторы не замерзают. Однако, разряженные аккумуляторы, в зависимости от уровня разрядки могут замерзать даже при температуре от до -10 градусов. На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
На состояние зарядки аккумуляторов в частности необходимо обращать внимание при холодной погоде.
Влияние погодных условий на аккумулятор:
1. При складировании и хранении:
Запрещается хранить аккумуляторы в закрытых помещениях. При хранении на открытом воздухе, пыль и осадки увеличивают риск саморазрядки аккумулятора. Хранить аккумуляторы следует по возможности в сухих и прохладных помещениях. Уровень разрядки аккумуляторов увеличивается или уменьшается параллельно температуре. Обычно, на каждые 10 градусов повышения температуры, потеря увеличивается в два раза. Поэтому, лучше хранить аккумуляторы при температуре 10-16 градусов, чем 25-30 градусов.
2. При работе в автомобиле:
В жаркую погоду стартовая сила аккумулятора повышается, но вместе с тем повышается и коррозия (износ). Поэтому, срок службы аккумуляторов, используемых в жарких климатических условиях, ниже. В холодных климатических условиях стартовая сила аккумулятора понижается. Вдобавок к этому, для запуска двигателя холодных условиях требуется больше энергии. Как результат, в холодных условиях стартовая сила аккумулятора приобретает значение. При очень холодной погоде имеется риск замерзания жидкости (электролита) в аккумуляторе. Полностью заряженный аккумулятор замерзает при температуре -70 градусов, а аккумулятор с низким уровнем заряда может замерзнуть даже при температуре -5 градусов. Поэтому, в холодное время очень важно, чтобы аккумулятор имел хороший уровень заряда.
Как результат, в холодных условиях стартовая сила аккумулятора приобретает значение. При очень холодной погоде имеется риск замерзания жидкости (электролита) в аккумуляторе. Полностью заряженный аккумулятор замерзает при температуре -70 градусов, а аккумулятор с низким уровнем заряда может замерзнуть даже при температуре -5 градусов. Поэтому, в холодное время очень важно, чтобы аккумулятор имел хороший уровень заряда.
При якій температурі замерзає морська вода. Наукова електронна бібліотека
Вода в морях і океанах дуже сильно відрізняється від річкової і озерної. Вона солона — і це визначає багато її властивості. Від цього фактора залежить і температура замерзання морської води. Вона не дорівнює 0 ° C, як у випадку з прісною водою. Щоб покритися льодом, моря потрібно мороз міцніше.
Сказати однозначно, при якій температурі замерзає морська вода, неможливо, так як цей показник залежить від ступеня її солоності. У різних місцях світового океану вона різна.
Найсолоніше — Червоне море. Тут концентрація солі у воді досягає 41 ‰ (проміле). Найменше солі в водах Балтійського затоки — 5 ‰. У Чорному морі цей показник дорівнює 18 ‰, а в Середземному — 26 ‰. Солоність Азовського моря — 12 ‰. А якщо брати в середньому, солоність морів становить 34,7 ‰.
Чим вище солоність, тим більше повинна охолонути морська вода для переходу в твердий стан.
Це добре видно з таблиці:
| Солоність, ‰ | Температура замерзання, ° C | Солоність, ‰ | Температура замерзання, ° C |
|---|---|---|---|
| 0 (прісна вода) | 20 | -1,1 | |
| 2 | -0,1 | 22 | -1,2 |
| 4 | -0,2 | 24 | -1,3 |
| 6 | -0,3 | 26 | -1,4 |
| 8 | -0,4 | 28 | -1,5 |
| 10 | -0,5 | 30 | -1,6 |
| 12 | -0,6 | 32 | -1,7 |
| 14 | -0,8 | 35 | -1,9 |
| 16 | -0,9 | 37 | -2,0 |
| 18 | -1,0 | 39 | -2,1 |
Там, де солоність ще вище, як, наприклад, в озері Сиваш (100 ‰), затоці Кара-Богаз-Гол (250 ‰), в Мертвому морі (понад 270 ‰), вода може замерзнути тільки при дуже великому мінусі — в першому випадку — при -6,1 ° C, у другому — нижче -10 ° C.
За середній же показник для всіх морів можна прийняти -1,9 ° C.
етапи замерзання
Дуже цікаво спостерігати, як замерзає морська вода. Вона не покривається відразу рівномірної крижаною кіркою, як прісна. Коли частина її перетворюється на лід (а він прісний), інший обсяг стає ще більш солоним, і для його замерзання потрібно ще більш міцний мороз.
види льоду
У міру охолодження в море утворюється лід різних видів:
- снежура;
- шуга;
- голки;
- сало;
- нілас.
Якщо море ще не замерзло, але дуже близько до цього, і в цей час випадає сніг, він при зіткненні з поверхнею не тане, а просочується водою і утворює в’язку кашоподібну масу, яка називається Снежура. Смерзаясь, ця каша перетворюється в шугу, яка дуже небезпечна для кораблів, що потрапили в шторм. Через неї палуба миттєво покривається крижаною кіркою.
Коли стовпчик термометра сягає потрібної для замерзання позначки, в море починають утворюватися крижані голки — кристали у формі дуже тонких шестигранних призм. Зібравши їх сачком, змив з них сіль і розтопивши, ви виявите, що вони прісні.
Зібравши їх сачком, змив з них сіль і розтопивши, ви виявите, що вони прісні.
Спочатку голки ростуть горизонтально, потім вони приймають вертикальне положення, і на поверхні видно лише їх підстави. Вони нагадують плями жиру в охолодженому супі. Тому лід на цій стадії називають салом.
Коли ще більше холоднішає, сало починає змерзатися і утворює крижану кірку, таку ж прозору і тендітну, як скло. Такий лід називають нілас, або склянка. Він солоний, хоча і утворений з прісних голок. Справа в тому, що під час смерзания голки захоплюють дрібні краплі навколишнього солоної води.
Тільки в морях спостерігається таке явище, як плавучі льоди. Виникає воно тому, що вода тут швидше остигає біля берегів. Утворений там лід примерзає до берегової кромки, тому й одержав назву припай. У міру посилення морозів під час тихої погоди він швидко захоплює нові території, досягаючи часом десятків кілометрів завширшки. Але варто піднятися сильного вітру — і припай починає розламуватися на шматки різної величини. Ці крижини, часто величезних розмірів (крижані поля), розносяться вітром і течією по всьому морю, створюючи проблеми судам.
Ці крижини, часто величезних розмірів (крижані поля), розносяться вітром і течією по всьому морю, створюючи проблеми судам.
температура танення
Тане морський лід не при тій же температурі, при якій замерзає морська вода, як можна було б подумати. Він менш солоний (в середньому в 4 рази), тому його перетворення назад в рідину починається раніше досягнення цієї позначки. Якщо середній показник замерзання морської води — -1,9 ° C, то середнє значення температури танення утворився з неї льоду — -2,3 ° C.
Замерзання солоної води: Відео
Читайте також
Як зробити водопровідну воду дистильованою
Що ви знаєте про температуру кипіння води?
Як морська вода впливає на волосся?
Якщо охолодити розчин будь-якої солі у воді, то виявиться, що температура замерзання знизилася. Нуль градусів пройдено, а затвердіння не відбувається. Тільки при температурі на кілька градусів нижче нуля в рідини з’являться кристалики. Це кристалики чистого льоду, в твердому льоді сіль не розчиняється.
Температура замерзання залежить від концентрації розчину. Збільшуючи концентрацію розчину, ми будемо зменшувати температуру кристалізації. Найнижчу температуру замерзання має насичений розчин. Зниження температури замерзання розчину зовсім мале: так, насичений розчин кухонної солі у воді замерзне при — 21 ° С. За допомогою інших солей можна домогтися ще більшого зниження температури; хлористий кальцій, наприклад, дозволяє довести температуру затвердіння розчину до -55 ° С.
Розглянемо тепер, як йде процес замерзання. Після того як з розчину випадуть перші кристали льоду, фортеця розчину збільшиться. Тепер відносне число чужих молекул зросте, перешкоди процесу кристалізації води також збільшаться, і температура замерзання впаде. Якщо не знижувати температуру далі, то кристалізація зупиниться.
При подальшому зниженні температури кристалики води (розчинника) продовжують виділятися. Нарешті, розчин стає насиченим. Подальше збагачення розчину розчиненим речовиною стає неможливим, і розчин застигає відразу, причому якщо розглянути в мікроскоп замерзлу суміш, то можна побачити, що вона складається з кристалів льоду і кристалів солі.
Таким чином, розчин замерзає не так, як проста рідина. Процес замерзання розтягується на великий температурний інтервал.
Що вийде, якщо посипати якусь обледеніла поверхню сіллю? Відповідь па питання добре відомий двірникам: як тільки сіль прийде в зіткнення з льодом, лід почне танути. Щоб явище мало місце, потрібно, звичайно, щоб температура замерзання насиченого розчину солі була нижча за температуру повітря. Якщо ця умова виконана, то суміш лід — сіль знаходиться в чужій області стану, а саме в області стійкого існування розчину. Тому суміш льоду з сіллю і буде перетворюватися в розчин, т. Е. Лід буде плавитися, а сіль розчинятися в утворюється воді. Зрештою або весь лід розтане, або утворюється розчин такої концентрації, температура замерзання якого дорівнює температурі середовища.
Площа дворика в 100 м 2 покрита крижаною кіркою в 1 см — це вже не мало льоду, близько 1 т. Підрахуємо, скільки солі потрібно для очищення двору, якщо температура -3 ° С. Такий температурою кристалізації (танення) володіє розчин солі з концентрацією 45 г / л. Приблизно 1 л води відповідає 1 кг льоду. Значить, для танення 1 т льоду при -3 ° С потрібно 45 кг солі. Практично користуються набагато меншими кількостями, так як не досягають повного танення всього льоду.
Приблизно 1 л води відповідає 1 кг льоду. Значить, для танення 1 т льоду при -3 ° С потрібно 45 кг солі. Практично користуються набагато меншими кількостями, так як не досягають повного танення всього льоду.
При змішуванні льоду з сіллю лід плавиться, а сіль розчиняється у воді. Але на плавлення потрібно тепло, і лід забирає його у свого оточення. Таким чином, додавання солі до льоду призводить до зниження температури.
Ми звикли зараз купувати фабричне морозиво. Раніше морозиво готували вдома, і при цьому роль холодильника грала суміш льоду з сіллю.
Досліди з льодом для дітей — це завжди цікаво. Проводячи досліди разом з Владом, я навіть зробила кілька відкриттів для себе.
Сьогодні знайдемо відповіді на наступні питання:
- як поводиться вода при заморожуванні?
- що буде, якщо заморозити солону воду?
- шуба зігріє лід?
- і деякі інші …
заморожування води
Вода при замерзанні розширюється. На фотографії стаканчик із замороженою водою. Видно, що лід піднявся горбком. Вода замерзає не рівномірно. Спочатку лід з’являється у стінок склянки, поступово заповнюючи весь посудину. У воді молекули рухаються хаотично, тому вона приймає форму судини, в який налита. Лід ж має чітку кристалічну структуру, при цьому відстані між молекулами льоду більше, ніж між молекулами води, тому лід займає більше місця, ніж вода, тобто розширюється.
Видно, що лід піднявся горбком. Вода замерзає не рівномірно. Спочатку лід з’являється у стінок склянки, поступово заповнюючи весь посудину. У воді молекули рухаються хаотично, тому вона приймає форму судини, в який налита. Лід ж має чітку кристалічну структуру, при цьому відстані між молекулами льоду більше, ніж між молекулами води, тому лід займає більше місця, ніж вода, тобто розширюється.
Солона вода замерзає?
Чим більш солона вода, тим нижче температура замерзання. Для експерименту ми взяли два стаканчика — в одному прісна вода (позначений буквою В), в іншому дуже солона вода (позначений літерами В + С).
Простоявши в морозилці всю ніч, солона вода так і не замерзла, але в стаканчику утворилися кристали льоду. Прісна вода перетворилася на лід. Поки я маніпулювала зі стаканчиками і розчинами солі , Владик створив свій незапланований експеримент.
Налив в кухоль воду, рослинне масло і непомітно поставив в морозилку. На наступний день я виявила кухоль з льодом і плаваючим помутнілим маслом. Робимо висновок, що різні рідини мають різну температуру замерзання.
Робимо висновок, що різні рідини мають різну температуру замерзання.
Солона вода в морозилці не замерзла, а що буде, якщо посипати лід сіллю? Перевіримо.
Досвід з льодом і сіллю
Візьмемо два кубики льоду. Один з них посиплемо сіллю, а другий залишимо для порівняння. Сіль роз’їдає лід, проробляючи канавки і ходи в крижаному кубику. Як і очікувалося, кубик льоду, посипаний сіллю, розтанув набагато швидше. Саме тому двірники взимку посипають доріжки сіллю. Якщо посипати сіллю лід, можна не тільки спостерігати за таненням, а й трохи помалювати!
Ми заморозили більшу крижинка і посипали її сіллю, взяли пензлика і акварельні фарби і стали творити красу Старший син наносив на лід фарбу пензлем, а молодший руками.
Наше дослідне творчість об’єднує всю сім’ю, ось і Макарушкина ручка потрапила в об’єктив фотоапарата!
Макар і Влад дуже люблять все заморожувати
. Іноді в морозилці знаходяться зовсім несподівані предмети.
Цей досвід я мріяла зробити ще з дитинства, але у мами не було шуби, а мн е потрібна була саме шуба і ніяких замінників! Улюблений купив мені шубу, і тепер представляю вашій увазі цей чудо-досвід. На початку я не уявляла, як можна зважитися на те, що б звернути морозиво в шубу, навіть якщо дуже хочеться поекспериментувати. А якщо досвід не вдасться, як її потім відпирати. Ех, була не була! ..
На початку я не уявляла, як можна зважитися на те, що б звернути морозиво в шубу, навіть якщо дуже хочеться поекспериментувати. А якщо досвід не вдасться, як її потім відпирати. Ех, була не була! ..
Морозиво поклала в пакетики 🙂 Загорнула шубою і стала чекати. Ура, все чудово! Шуба ціла, і морозиво розтануло набагато менше, ніж контрольний зразок, який стояв поруч без шуби.
Як же здорово бути дорослою, мати шубу і робити які завгодно дитячі досліди!
Діти люблять фарбувати і прикрашати. А кольоровий лід доставляє масу позитивних емоцій і дозволяє розвивати творчість у малюків. Досліди не просто яскраві, пізнавальні, а й корисні. Рецепти ще більшої кількості яскравих експериментів для дітей дарую вам зараз. Завантажуйте корисний збірник дослідів для вашої домашньої лабораторії — » Досліди з водою «. Пишіть в коментарях ваші відгуки про досліди та побажання: які досліди ви б хотіли побачити на сторінках нашого сайту. Наука — це ж весело.
Ваша Галина Кузьміна
У розділі на питання яку можна досягти най-нізчайшую температуру водно-сольового розчину звичайної (кухонної, NaCl) солі заданий автором Європейський краща відповідь це Завдяки додаванню солі в воду швидкість танення льоду збільшується, а температура танення льоду опускається нижче. Це пояснюється тим, що додавання солі викликає ослаблення молекулярного зчеплення і руйнування кристалічних решіток льоду. Танення льодосоляною суміші протікає з відбором теплоти від навколишнього середовища, в результаті чого навколишнє повітря охолоджується і температура його знижується. З підвищенням вмісту солі в льодосоляною суміші температура плавлення її знижується. Розчин солі з найнижчою температурою танення називається евтектичним, а температура його танення — кріогідратной точкою. Кріогідратная точка для льодосоляною суміші з кухонною сіллю -21,2 ° С, при концентрації солі в розчині 23,1% по відношенню до загальної маси суміші, що приблизно дорівнює 30 кг солі на 100 кг льоду. При подальшому підвищенні концентрації солі відбувається не зниження температури танення льодосоляною суміші, а підвищення температури танення (при 25% -ної концентрації солі в розчині до загальної маси температура танення підвищується до -8 ° С).
Це пояснюється тим, що додавання солі викликає ослаблення молекулярного зчеплення і руйнування кристалічних решіток льоду. Танення льодосоляною суміші протікає з відбором теплоти від навколишнього середовища, в результаті чого навколишнє повітря охолоджується і температура його знижується. З підвищенням вмісту солі в льодосоляною суміші температура плавлення її знижується. Розчин солі з найнижчою температурою танення називається евтектичним, а температура його танення — кріогідратной точкою. Кріогідратная точка для льодосоляною суміші з кухонною сіллю -21,2 ° С, при концентрації солі в розчині 23,1% по відношенню до загальної маси суміші, що приблизно дорівнює 30 кг солі на 100 кг льоду. При подальшому підвищенні концентрації солі відбувається не зниження температури танення льодосоляною суміші, а підвищення температури танення (при 25% -ної концентрації солі в розчині до загальної маси температура танення підвищується до -8 ° С).
При заморожуванні водного розчину кухонної солі в концентрації, що відповідає кріогідратной точці, виходить однорідна суміш кристалів льоду і солі, яка називається евтектичним твердим розчином.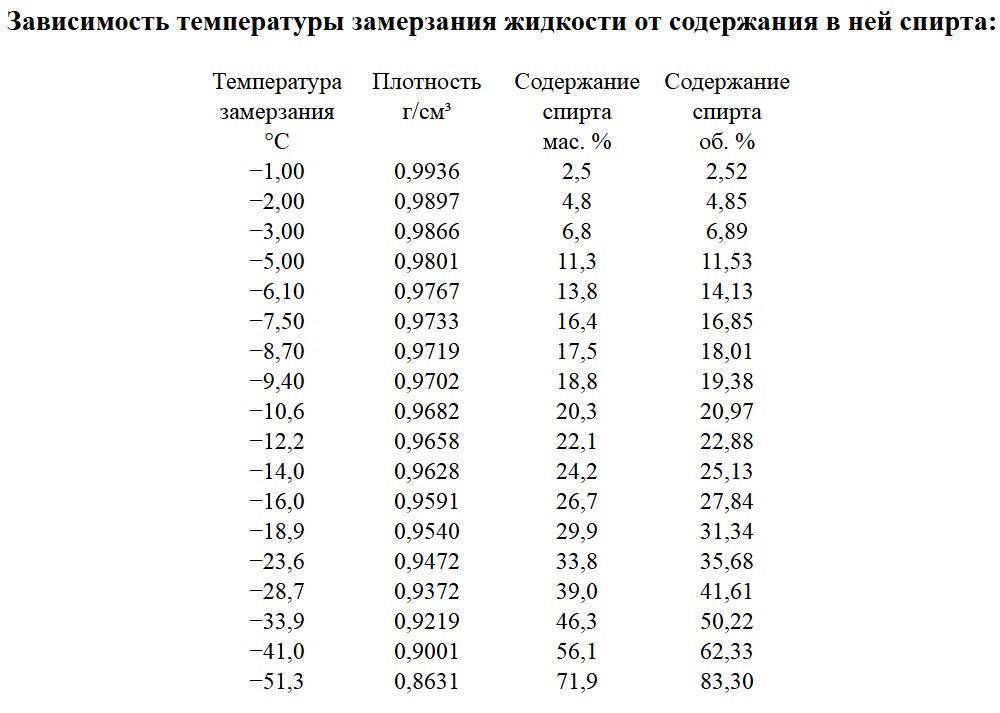
Температура плавлення евтектичного твердого розчину кухонної солі -21,2 ° С, а теплота плавлення — 236 кДж / кг. Евтектичних розчин застосовують для зероторного охолодження. Для цього в зероти — наглухо запаяні форми — заливають евтектичних розчин кухонної солі і заморожують їх. Заморожені зероти використовують для охолодження прилавків, шаф, охолоджуваних переносних сумок-холодильників і т. Д. (Відкрийте морозилку побутового холодильника — знайдете такий контейнер) .В торгівлі Льодосоляне охолодження широко застосовувалося до масового випуску обладнання з машинним способом охолодження.
відповідь від просохнути[Гуру]
найнижча температура з будь-якої температури — абсольтно нуль, близько — 273 градуса Цельсія
відповідь від Оля[Експерт]
температура залежить від концентрації солі в розчині, чим більше концентрація, тим нижче температура замерзанія.Точних цифр не скажу, тому що довідник у мене на час відібрали)) але якщо виходити з того, що морська вода-це сольовий розчин, то можна зробити висновок, що температура замерзання гараздо нижче нуля . … градусів -15-20
… градусів -15-20
відповідь від здатний[Гуру]
22,4% -ний водний розчин NaClзамерзает при 21,2 ° С
відповідь
посилання
на питання
Водний розчин NaCl «температура кристалізації»
відповідь від YOергей Незнамов[Новачок]
Таблиця 10.8. Температура замерзання розчину NaCl
Зміст NaCl, г в 100 г води Температура замерзання,? С
1,5 — -0,9
3,0 — — 1,8
4,5 — -2,6
5,9 — -3,5
7,5 — -4,4
9,0 — -5,4
10,6 — -6,4
12,3 — -7,5
14,0 — -8,6
15,7 — -9,8
17,5 — -11,0
19,3 — — 12,2
21,2 — -13,6
23,1 — — 15,1
25,0 — — 16,0
26,9 — -18,2
29,0 — -20,0
30,1 — -21,2
При какой температуре замерзает вода? |
Наука
Название этого поста могло бы показаться подходящим вопросом для экзамена по естествознанию в начальной школе, но ответ намного сложнее, чем кажется на первый взгляд. Нас всех учили, что вода замерзает при 32 градусах по Фаренгейту, 0 градусам Цельсия, 273,15 Кельвина. Однако это не всегда так. Ученые обнаружили жидкую воду с температурой -40 градусов по Фаренгейту в облаках и даже охлаждающую воду до -42 градусов по Фаренгейту в лаборатории.Как низко они могли опуститься?
Однако это не всегда так. Ученые обнаружили жидкую воду с температурой -40 градусов по Фаренгейту в облаках и даже охлаждающую воду до -42 градусов по Фаренгейту в лаборатории.Как низко они могли опуститься?
На этот вопрос сложно ответить. Когда жидкая вода охлаждается ниже -42 градусов по Фаренгейту, она слишком быстро кристаллизуется в лед, и ученые не могут измерить температуру жидкости. Эмили Мур и Валерия Молинеро из Университета штата Юта разработали сложное компьютерное моделирование 32 768 молекул воды (меньше молекул, чем можно найти в капле дождя), которое позволило им увидеть, что происходит с теплоемкостью, плотностью и сжимаемостью воды при ее переохлаждении и переохлаждении. определить, что произошло, когда 4 000 из этих молекул замерзли.Их результаты опубликованы в журнале Nature .
Когда температура воды приближается к -55 градусов по Фаренгейту, молекулы воды образуют тетраэдры, каждая из которых слабо связана с четырьмя другими молекулами. Уменьшается плотность воды, увеличивается ее теплоемкость и увеличивается сжимаемость. «Изменение структуры воды контролирует скорость образования льда», — говорит Молинеро. «Мы показываем, что термодинамика воды и скорость кристаллизации контролируются изменением структуры жидкой воды, которая приближается к структуре льда.«При температуре ниже -55 градусов по Фаренгейту крошечные кусочки жидкой воды все еще могут существовать, но они будут существовать только в течение невероятно короткого времени, — говорит Молинеро.
Уменьшается плотность воды, увеличивается ее теплоемкость и увеличивается сжимаемость. «Изменение структуры воды контролирует скорость образования льда», — говорит Молинеро. «Мы показываем, что термодинамика воды и скорость кристаллизации контролируются изменением структуры жидкой воды, которая приближается к структуре льда.«При температуре ниже -55 градусов по Фаренгейту крошечные кусочки жидкой воды все еще могут существовать, но они будут существовать только в течение невероятно короткого времени, — говорит Молинеро.
Такое переохлаждение воды возможно, потому что воде требуется небольшое ядро или затравка льда, чтобы молекулы образовывали кристаллы, и в очень чистой воде «единственный способ сформировать ядро - это спонтанно изменить структуру жидкости», — говорит Молинеро. . Эти ядра не сформируются и не станут достаточно большими, пока структура молекул жидкой воды не приблизится к структуре твердого льда, чего не произойдет, пока вода не станет настолько невероятно холодной.
( HT: io9 )
Понравилась статья?
ПОДПИШИТЕСЬ на нашу рассылку новостей
При какой температуре замерзает вода?
Фил Розенберг 6 мин Без крошечных частиц пыли в атмосфере, обеспечивающих точки зарождения, кристаллы льда не могли бы образоваться в атмосфере, пока температура не упала примерно до минус 30 по Цельсию
Мы все думаем, что знаем ответ на этот вопрос вопрос.Моя шестилетняя дочь определенно любит. Ее, как и всех остальных, учили на одном из самых ранних уроков естествознания, что лед — это замороженная вода, а вода замерзает при нулевой температуре по Цельсию. Некоторые из вас также могут знать, что шкала Цельсия изначально была установлена на ноль, определяемую как точка замерзания воды , и мы небрежно говорим, что температура ниже нуля, когда она меньше нуля. Оказывается, ваша учительница начальных классов ошиблась. Ну, они частично ошиблись.
Ну, они частично ошиблись.
Если мы вместо этого рассмотрим таяние льда, то это действительно произойдет при нуле Цельсия. Как только лед достигает нуля, он начинает таять. Но с замораживанием все обстоит иначе. Фактически, чистая вода может легко охлаждаться до температуры ниже нуля по Цельсию и оставаться жидкой водой. Мы называем это переохлажденной водой. Причина этого в том, что молекулы воды отталкиваются друг от друга даже при температуре ниже нуля по Цельсию. Они будут слипаться друг с другом, образуя лед, только если их можно сильно прижать друг к другу в определенной ориентации.
Представьте, что ваша машина сломалась, а между вами и домом возвышается холм. Хотя на самом деле ваш дом может находиться на более низкой высоте, чем место, где вы сломались, вам придется очень сильно потрудиться, чтобы подтолкнуть машину к одной стороне холма, прежде чем сила тяжести потянет ее до самого конца вниз с другой стороны. В физике мы называем это энергетическим барьером , , . Как только молекула воды преодолевает барьер, она прилипает к нему, образуя лед, но молекуле трудно преодолеть барьер, чтобы сделать это.
Как только молекула воды преодолевает барьер, она прилипает к нему, образуя лед, но молекуле трудно преодолеть барьер, чтобы сделать это.
Как преодолеть энергетический барьер
Если это так, то почему мы можем выйти на улицу холодным утром и обнаружить, что все лужи замерзли? Есть два способа преодолеть энергетический барьер. Первый — еще больше охладить воду. Но на самом деле вода может оставаться в виде переохлажденной жидкой воды вплоть до температуры около минус 30 градусов Цельсия . Мы никогда не видели таких низких температур в Великобритании. Другой способ преодолеть энергетический барьер — обеспечить поверхность для замерзания воды.
Физика того, как это работает, все еще недостаточно изучена, но кажется, что лед начинает формироваться в определенной точке на поверхности, известной как место зарождения. У некоторых материалов много хороших центров зародышеобразования, у некоторых их очень мало. Даже ученые, работающие на передовых рубежах в этой области, еще не до конца понимают, почему. Одно мы точно знаем, это то, что у самого льда есть много мест зарождения; поэтому, как только лед начинает формироваться, вся вода может быстро замерзнуть — если она остается ниже нуля.
Одно мы точно знаем, это то, что у самого льда есть много мест зарождения; поэтому, как только лед начинает формироваться, вся вода может быстро замерзнуть — если она остается ниже нуля.
Все это означает, что, хотя вода и хочет замерзнуть при нуле, она не может этого сделать, пока в месте зародышеобразования не начнется крошечный кристалл льда; тогда вся вода может быстро замерзнуть. Два типа материала, которые, кажется, имеют много точек зародышеобразования, — это определенные типы измельченной породы и определенные бактерии. Почва под лужей полна как крошечных обломков камней, так и бактерий, поэтому лужи замерзнут, даже если температура на улице чуть ниже нуля.
Лед в облаках
Даже летом облака в Великобритании часто становятся достаточно холодными, чтобы образовался лед. Но вода в облаках не имеет почвы, чтобы замерзнуть. В высокогорном перистом облаке или на наковальне кучево-дождевого облака температура опускается ниже минус тридцати градусов по Цельсию, поэтому все капли замерзают. Но считается, что в облаках на более низких высотах частицы пыли, вылетающие из пустынь мира и взвешенные в атмосфере, создают места зарождения льда в большинстве облаков. Бактерии, переносимые ветром, тоже могут внести свой вклад.
Оба этих типа частиц немногочисленны, поэтому только часть облачных капель может замерзнуть на этих поверхностях, но даже эти несколько замороженных капель могут иметь огромное влияние.Кристаллы льда могут расти намного быстрее, чем капли воды. Когда они становятся достаточно большими, они выпадают из нижней части облака в виде снега или крупы, а некоторые тают по пути вниз, достигая нас в виде мокрого снега или дождя. Большинство зимних дождей и даже много летних дождей в Великобритании начинают свою жизнь как снег в облаках — тающий при падении . Этот важный фактор означает, что образование льда на микроскопических точках поверх пылинок может иметь огромное влияние на наши осадки.
Может ли вода оставаться жидкой при температуре ниже нуля градусов Цельсия?
Категория: Химия Опубликовано: 9 декабря 2013 г.
Температура замерзания воды опускается ниже нуля градусов Цельсия при приложении давления.Public Domain Image, источник: Кристофер С. Бэрд.
Да, вода может оставаться жидкой при температуре ниже нуля градусов Цельсия. Это может произойти несколькими способами.
Прежде всего, фаза материала (будь то газ, жидкость или твердое тело) сильно зависит как от его температуры , так и от давления . Для большинства жидкостей приложение давления повышает температуру, при которой жидкость замерзает до твердого состояния. Твердое тело образуется, когда рыхлые извилистые молекулы жидкости становятся достаточно медленными и достаточно близкими, чтобы образовать устойчивые связи, которые закрепляют их на месте.Когда мы оказываем давление на жидкость, мы заставляем молекулы сближаться. Поэтому они могут образовывать стабильные связи и становиться твердыми, даже если их температура выше точки замерзания при стандартном давлении. Однако вода в чем-то уникальна. Молекулы воды распространяются, когда они соединяются в твердую кристаллическую структуру. Это растекающееся действие приводит к тому, что лед становится менее плотным, чем жидкая вода, что приводит к плаванию льда. Это расширяющее действие молекул воды во время замерзания также означает, что приложение давления к воде понижает точку замерзания .Если вы приложите достаточное давление (что затрудняет распространение молекул воды в твердую структуру), вы можете получить жидкую воду на несколько градусов ниже нуля по Цельсию.
Даже если вы не применяете давление, вы все равно можете получать жидкую воду при минусовых температурах с использованием добавок. Добавки, такие как соль, могут мешать химическому связыванию, необходимому для образования твердого вещества, и, следовательно, могут снизить температуру замерзания воды. Соль состоит из сильных ионов натрия и хлора. При растворении в воде молекулы воды имеют тенденцию прилипать к ионам соли, а не друг к другу, и поэтому они не так быстро замерзают.По мере того, как вы добавляете больше соли в воду, ее точка замерзания продолжает падать, пока вода не достигнет насыщения и не сможет больше удерживать соль. Если вы добавите достаточно соли, точка замерзания воды может упасть до -21 градус Цельсия. Это означает, что вода с температурой -21 градус Цельсия может оставаться жидкой, если добавить достаточно соли. Вместо того, чтобы предохранять жидкую воду от замерзания, это мощное свойство соли также можно использовать для превращения льда обратно в воду. При рассыпании соли на обледенелых тротуарах температура замерзания льда становится ниже температуры окружающей среды, и лед тает.Но посыпать ледяные дорожки солью не поможет, если температура окружающего воздуха ниже -21 градуса Цельсия. Влияние соли на точку замерзания воды также оказывает сильное влияние на океаны Земли.
Даже если вы не применяете давление и ничего не добавляете в воду, у вас все равно может быть жидкая вода при температуре ниже нуля градусов Цельсия. Для того, чтобы вода замерзла до состояния льда, ей нужно что-нибудь заморозить, чтобы начать процесс. Мы называем эти отправные точки «центрами зародышеобразования».В большинстве случаев небольшое количество пыли, примесей или даже небольшие колебания в воде создают центры зародышеобразования, на которых вода может замерзнуть. Но если ваша вода очень чистая и неподвижная, молекулам воды не на чем кристаллизоваться. В результате вы можете охлаждать очень чистую воду до температуры ниже нуля градусов по Цельсию, не замерзая. Вода в таком состоянии называется «переохлажденной». При стандартном давлении чистая вода может быть переохлаждена примерно до -40 градусов по Цельсию. Переохлажденная вода не замерзает только из-за отсутствия центров зародышеобразования.Следовательно, как только создаются центры зародышеобразования (что может быть столь же простым, как вибрация), переохлажденная вода быстро замерзает. Ледяной дождь — естественный пример переохлажденной жидкой воды. Как только ледяной дождь попадает на объект на поверхности земли, этот объект образует центры зародышеобразования, и дождь превращается в лед.
Темы:
замораживание, точка замерзания, ледяной дождь, лед, фазовая диаграмма, давление, переохлаждение, температура, вода
Вода не должна замерзать до -48 C (-55 F) — ScienceDaily
Мы пьем воду, купаемся в ней, и мы в основном состоим из воды, но общее вещество таит в себе большие загадки.Теперь химики из Университета Юты, возможно, решили одну загадку, показав, как холодная вода может пройти до того, как она обязательно замерзнет: 48 градусов ниже нуля по Цельсию (минус 55 по Фаренгейту).
Это на 48 градусов по Цельсию (87 градусов по Фаренгейту) холоднее, чем то, что большинство людей считает точкой замерзания воды, а именно 0 C (32 F).
Переохлажденная жидкая вода должна превратиться в лед при температуре минус 48 ° C (минус 55 ° F) не только из-за сильного холода, но и из-за того, что молекулярная структура воды физически изменяется, образуя форму тетраэдра, причем каждая молекула воды слабо связана с четырьмя другими, согласно новое исследование химиков Валерии Молинеро и Эмили Мур.
Результаты показывают, что это структурное изменение от жидкого до «промежуточного льда» объясняет загадку того, «что определяет температуру, при которой вода замерзнет», — говорит Молинеро, доцент Университета Юты и старший автор исследования. опубликовано в номере журнала Nature от 24 ноября.
«Этот промежуточный лед имеет структуру между полной структурой льда и структурой жидкости», — добавляет она. «Мы решаем очень старую загадку того, что происходит в сильно переохлажденной воде.«
Однако в странном и дурацком мире воды крошечные количества жидкой воды теоретически все еще могут присутствовать, даже если температура опускается ниже минус 48 ° C (минус 55 ° F) и почти вся вода превратилась в твердую фазу — либо в кристаллический лед, либо аморфное водяное «стекло», — говорит Молинеро. Но любая оставшаяся жидкая вода может выжить только невероятно короткое время — слишком короткое, чтобы свойства жидкости можно было обнаружить или измерить.
Как и при какой температуре вода должна замерзнуть — это не просто «чудо».Атмосферные ученые, изучающие глобальное потепление, хотят знать, при каких температурах и с какой скоростью вода замерзает и кристаллизуется в лед.
«Это необходимо, чтобы предсказать, сколько воды в атмосфере находится в жидком или кристаллическом состоянии», что относится к тому, сколько солнечной радиации поглощается атмосферной водой и льдом, — говорит Молинеро. «Это важно для прогнозов глобального климата».
Странное вещество
Жидкая вода — это сеть молекул воды (каждая с двумя атомами водорода и одним атомом кислорода), свободно скрепленных так называемой водородной связью, которая чем-то похожа на статическое сцепление.Молинеро говорит, что в зависимости от температуры и давления водяной лед имеет 16 различных кристаллических форм, в которых молекулы воды цепляются друг за друга водородными связями.
Молинеро говорит: «Что делает воду такой странной, так это то, что поведение жидкой воды полностью отличается от поведения других жидкостей. Например, лед плавает по воде, в то время как большинство твердых веществ переходят в жидкие формы, потому что они более плотные, чем жидкости».
Плотность воды изменяется в зависимости от температуры, и она наиболее плотная при 4 ° C (39 F).Вот почему рыба выживает под льдом, покрывающим пруд, купаясь в более теплой и плотной воде на дне пруда.
Но самое удивительное свойство воды состоит в том, что ее можно охладить до температуры ниже 32 градусов по Фаренгейту [нуля по Цельсию], и она по-прежнему остается жидкостью », — говорит Молинеро.
Жидкая вода с температурой минус 40 ° C (минус 40 ° F) была обнаружена в облаках. Ученые провели эксперименты, показавшие, что жидкая вода может существовать, по крайней мере, до минус 41 ° C (минус 42 ° F).
Почему вода не обязательно замерзает при 0 C (32 F), как нас учили в школе?
«Если у вас есть жидкая вода и вы хотите образовать лед, то сначала вы должны сформировать из жидкости небольшое ядро или зерно льда. Жидкость должна дать начало льду», — говорит Молинеро. «Для дождя вы должны сделать жидкость из пара. Здесь вы должны сделать кристалл [лед] из жидкости».
Однако в очень чистой воде «единственный способ сформировать ядро - это спонтанно изменить структуру жидкости», — добавляет она.
Молинеро говорит, что ключевые вопросы включают: «При каких условиях ядра образуются и становятся достаточно большими, чтобы расти?» и «Каков размер этого критического зародыша?»
Вычисление того, что нельзя измерить
Молинеро говорит, что «когда вы охлаждаете воду, ее структура становится ближе к структуре льда, поэтому плотность уменьшается, и это должно отражаться в увеличении скорости кристаллизации».
Переохлажденная вода была измерена до минус 41 C (минус 42 F), что является ее «температурой гомогенного зародышеобразования» — самой низкой температурой, при которой скорость кристаллизации льда может быть измерена при замерзании воды.Ниже этой температуры лед кристаллизуется слишком быстро, чтобы можно было измерить какие-либо свойства оставшейся жидкости.
Чтобы обойти проблему, Молинеро и аспирант по химии Мур использовали компьютеры в Центре высокопроизводительных вычислений Университета Юты. Поведение переохлажденной воды моделировалось, а также моделировалось с использованием реальных данных.
По словам Молинеро, компьютеры
обеспечивают «микроскопическое изображение посредством моделирования, которого пока не могут обеспечить эксперименты».
Предыдущие компьютерные симуляции и моделирование были слишком медленными и должны были длиться достаточно долго, чтобы произошел процесс замораживания.И необходимо было смоделировать тысячи событий нуклеации, чтобы сделать обоснованные выводы.
Молинеро и Мур разработали новую компьютерную модель, которая в 200 раз быстрее своих предшественников. Модель упростила вычисление чисел, рассматривая каждую трехатомную молекулу воды как одну частицу, подобную атому кремния и способную склеиваться водородными связями.
Несмотря на это, потребовались тысячи часов компьютерного времени, чтобы смоделировать поведение 32 768 молекул воды (намного меньше, чем крошечная капля воды), чтобы определить, как теплоемкость, плотность и сжимаемость воды изменяется при ее переохлаждении, и смоделировать процесс кристаллизации припая в партии из 4000 молекул воды.
Рождение льда
Компьютеры помогли Молинеро и Муру определить, сколько холодной воды может пройти, прежде чем она достигнет своей теоретической максимальной скорости кристаллизации и должна замерзнуть. Ответ: минус 48 ° C (минус 55 ° F).
Компьютеры также показали, что по мере того, как вода приближается к минус 48 ° C (минус 55 ° F), происходит резкое увеличение доли молекул воды, прикрепленных к четырем другим молекулам с образованием тетраэдров.
«Вода превращается во что-то другое, и это нечто очень похоже на лед», — говорит Молинеро.Она называет это промежуточным льдом.
Если микроскопическая капля воды охлаждается очень быстро, она образует так называемое стекло — аморфный лед низкой плотности, в котором все тетраэдры молекул воды не выстраиваются в одну линию, чтобы образовать идеальные кристаллы. Вместо этого лед низкой плотности аморфен, как оконное стекло. Исследование показало, что до четверти молекул в аморфном «жидком стекле» организованы либо в виде промежуточного льда, либо в виде крошечных кристаллов льда.
Когда вода приближается к минус 48 C (минус 55 F), наблюдается необычное снижение плотности и необычное увеличение теплоемкости (которая идет вверх, а не вниз) и сжимаемости (вода становится легче сжиматься по мере того, как она становится холоднее, в отличие от большинства жидкостей. ).Эта необычная термодинамика совпадает с переходом жидкой воды в тетраэдрическую структуру.
«Изменение структуры воды контролирует скорость образования льда», — говорит Молинеро. «Мы показываем, что и термодинамика воды, и скорость кристаллизации контролируются изменением структуры жидкой воды, которая приближается к структуре льда».
Ученые переохлаждали воду, не замораживая ее
Вода стала еще страннее.Эта уникальная жидкость, невероятно простая и в то же время невероятно сложная, сумела еще раз удивить нас. Две группы, работающие независимо друг от друга, смогли охладить жидкую воду до -42,55 градусов по Цельсию (-44,59 градусов по Фаренгейту). Они считают, что эта точка — математическая особенность.
Художественное представление.
Все знают, что такое вода, и все же немногие люди, если таковые имеются, могут утверждать, что действительно понимают это вещество. Это самая распространенная и важная жидкость на Земле, но при этом одна из самых загадочных.С детства нас учили, что вода замерзает при 0 градусах Цельсия или 32 градусах по Фаренгейту (273,15 Кельвина, если мы действительно хотим стать педантичными). Затем, когда мы вырастем, мы узнаем, что точка замерзания воды также зависит от давления. Мы также знаем, что в особых условиях (например, при очень быстром охлаждении) температура замерзания воды может быть еще ниже. Но до недавнего времени никто не знал, что температура замерзания воды может опускаться ниже -40 градусов. Другими словами, возможно понижение температуры до -42 капель воды.55 ° C (-44,59 ° F) без замерзания.
Чтобы продемонстрировать это, исследователи из Франкфуртского университета Гете впервые применили новую технику. Они вводили очень крошечные капли в вакуумную камеру — камеру без чего-либо внутри, даже без воздуха. По мере того, как капли проходят через камеру, некоторые из них испаряются, и в результате этого процесса температура остальных капель понижается. Но измерить температуру было непросто.
Когда вы имеете дело с такими весами, вы не можете воткнуть внутрь термометр, чтобы определить температуру.Вместо этого они использовали лазеры, чтобы измерить изменение диаметра капель, а затем вычислили из этого температуру. С помощью этой техники они также смогли показать, что, хотя часть воды действительно образовывала кристаллы льда, часть оставалась жидкой даже при таких ужасно низких температурах.
В отдельной статье Андерс Нильссон из Стокгольмского университета и его коллеги также охлаждали микрокапли внутри вакуума. Но они сосредоточились на другом, на чем-то еще более странном. Используя высокоскоростной рентгеновский снимок, они доказали, что вода может существовать как две разные жидкости с разными способами связывания молекул воды.Другими словами, вода не может принимать ту или иную форму, не колеблясь между ними какое-то время.
Различные части капель имели разную плотность, что указывает на странное поведение, которое в математике называется сингулярностью
«Особенностью было то, что мы могли делать рентгеновские лучи невообразимо быстро до того, как лед замерз, и могли наблюдать, как он колеблется между двумя состояниями», — говорит Нильссон, профессор химической физики Стокгольмского университета и автор статьи Science , говорится в пресс-релизе университета.«В течение десятилетий существовали предположения и различные теории, объясняющие эти замечательные свойства и почему они становятся сильнее, когда вода становится холоднее. Теперь мы нашли такой максимум, а это значит, что при более высоких давлениях также должна быть критическая точка ».
Паола Галло из Университета Рома Тре в Италии, написавшая статью о перспективах в том же выпуске Science , впечатлена результатом.
«Этой группе удалось выйти за пределы достигнутого ранее переохлаждения», — говорит она.«Это означает, что в будущем мы можем пойти еще дальше. Есть области, в которых важно избегать кристаллизации: например, одна из них — криоконсервация. В этих случаях, например, может помочь раствор, поэтому очень важно знать, какова точная плотность воды и какова точная структура, которую вода принимает в переохлажденной фазе ».
Между тем, Алан Сопер из британской лаборатории Резерфорда Эпплтона заинтригован, но он также немного осторожнее. Он говорит, что мы до сих пор не знаем точно, что видим, и ни одна из команд не предлагает четкого объяснения причины этого явления.
«Они что-то ясно увидели, и это очень интересно», — заключает он. «Но то, что на самом деле вызывает это, вероятно, является тем, на что у нас нет однозначного ответа».
Есть также важные практические последствия этого исследования. Речь идет не только о воде, обманчиво сложной жидкости, которая на протяжении веков озадачивала исследователей. Переохлажденная жидкая вода может естественным образом образоваться в атмосфере Земли, и это может оказать значительное влияние на метеорологические явления.Лучшее понимание этого процесса может позволить исследователям улучшить как климатические модели, так и прогноз погоды.
Ссылка на журнал:
- Клаудиа Гой и др. Сжатие быстро испаряющихся микрокапель воды показывает их чрезмерное переохлаждение . DOI: 10.1103 / PhysRevLett.120.015501, Arxiv : https://arxiv.org/abs/1711.02412
- Kyung Hwan Kim et al. Максимумы термодинамического отклика и корреляционных функций глубоко переохлажденной воды .DOI: 10.1126 / science.aap8269
Как замерзает вода? | Sciencing
Замораживание и молекулярное движение
Когда вода замерзает, она обычно переходит из жидкого состояния в твердое. Как жидкость, молекулы воды находятся в постоянном движении, натыкаясь и толкая друг друга и никогда не остаются надолго на одном месте.Когда вода замерзает, молекулы замедляются и оседают на месте, выстраиваясь в регулярные образования, которые вы видите как кристаллы. Для чистой воды температура должна упасть до 32 градусов по Фаренгейту (ноль градусов Цельсия), чтобы это произошло. Для любого вещества температура, при которой происходит замерзание, зависит от сил, заставляющих его молекулы слипаться.
Липкие молекулы и точка замерзания
Все молекулы и атомы обладают силами, притягивающими друг друга. Некоторые атомы, например углерод, очень сильно держатся друг за друга; другие, такие как гелий, обладают очень небольшой силой притяжения.Вещества с сильными силами притяжения замерзают при температуре в тысячи градусов по Фаренгейту, тогда как вещества со слабыми силами, такие как азот, замерзают при очень низких температурах. Притяжение между молекулами воды умеренное — ни слабое, ни сильное — поэтому вода замерзает при скромных 32 градусах по Фаренгейту.
Понижение точки замерзания
Если вы добавите в воду другие вещества, например сахар или соль, температура упадет ниже 32 градусов, прежде чем начнется образование льда. Новая точка замерзания зависит от добавляемого вещества и от того, сколько вы смешиваете с водой, поэтому в некоторых штатах города добавляют соль на дороги, чтобы удалить лед и снег зимой.Другой пример: водка, смесь воды и спирта, остается жидкой в течение длительного периода времени при хранении в морозильной камере. Алкоголь в водке значительно снижает температуру замерзания.
Замораживание, расширение и образование кристаллов
Большинство веществ сжимаются или сжимаются в объеме при охлаждении. Вода сжимается только до тех пор, пока не опустится до 39 градусов; при более низких температурах он начинает расширяться. По мере того, как вода становится холоднее, ее молекулы замедляются и располагаются так, что между группами молекул возникают промежутки.По мере того, как они становятся холоднее, молекулы образуют гексагональные узоры, которые в конечном итоге становятся снежинками и связанными с ними кристаллами.
Force Of Ice Expansion
Если вы наполните бутылку полностью наполненной водой, затем закройте ее крышкой перед тем, как положить ее в морозильную камеру, вода расширяется по мере того, как становится холоднее. В конце концов лед лопнет бутылку. Это справедливо даже для емкостей из прочных материалов, таких как железо; давление замерзающей воды достигает 40 000 фунтов на квадратный дюйм при минус 7.6 градусов по Фаренгейту (минус 22 градуса по Цельсию).
Какая точка замерзания воды?
по Фаренгейту, Цельсию и Кельвину. Температура замерзания воды составляет 32 градуса по Фаренгейту, 0 градусов Цельсия и 273,15 Кельвина.
Вы знаете температуру замерзания воды? Точка замерзания такая же, как точка плавления? Вот посмотрите на температуру точки замерзания, факторы, которые на нее влияют, и на то, совпадает ли она с точкой плавления.
Температура нормальной точки замерзания воды
Температура точки замерзания воды составляет 32 ° F, 0 ° C или 273.15 К . Обратите внимание, что у температуры Кельвина отсутствует символ градуса, потому что шкала Кельвина является абсолютной шкалой температуры. Это температура, при которой жидкая вода претерпевает фазовый переход в твердый лед при давлении в 1 атмосферу.
Разница между точкой замерзания и точкой плавления
Точка замерзания — это температура, при которой жидкость превращается в твердое тело, а точка плавления — это температура, при которой твердое вещество превращается в жидкость. Для большинства практических целей эти две температуры одинаковы.Таким образом, температура плавления воды также составляет 32 ° F, 0 ° C или 273,15 K.
Иногда точка замерзания чистой воды может быть намного ниже, чем нормальная точка замерзания или точка плавления. Причина в том, что воду легко переохлаждать. Переохлажденная вода — это вода, в которой отсутствуют примеси, пузырьки воздуха или дефекты поверхности, которые способствуют образованию кристаллов. Очень чистая вода в гладком контейнере может достигнуть температуры от -40 до -42 ° F (-40 ° C) до того, как она замерзнет!
Факторы, которые могут изменить точку замерзания
Если вы посмотрите на фазовую диаграмму, вы увидите, что температура точки замерзания зависит от давления.Для большинства веществ снижение давления ниже 1 атмосферы снижает точку замерзания. Однако с водой происходит обратное. Повышение давления сначала дает более низкую температуру замерзания. Причина в том, что водородная связь между молекулами воды делает жидкость более плотной, чем твердое тело, и очень стабильной. При очень низком давлении вода превращается непосредственно из водяного пара в лед, не становясь жидкостью.
Температура замерзания воды зависит от ее давления. (Изображение: Cmglee, CC 3.0)
Примеси также влияют на температуру замерзания воды.Почти во всех случаях растворение вещества (например, сахара, соли, спирта) снижает температуру замерзания. Это называется понижением точки замерзания. Это коллигативное свойство вещества, что означает, что оно зависит от количества частиц, добавленных в воду, а не от химической природы частиц. Ученые из Университета Лидса обнаружили исключение для депрессии точки замерзания. Сульфат аммония, соль, фактически повышает температуру замерзания воды.
Частицы, не растворяющиеся в воде, например пыль или пыльца, также повышают температуру замерзания воды.Частицы действуют как точки зарождения. По сути, они дают молекулам воды точку прикрепления, чтобы начать процесс кристаллизации в лед. Горнолыжные курорты используют это свойство, чтобы делать снег при температуре выше нуля.
Ссылки
- Atkins, P.W. (2017). Элементы физической химии . ISBN 978-0-19-879670-1.
- Pedersen, U.R .; и другие. (Август 2016 г.). «Термодинамика замерзания и плавления». Nature Communications . 7 (1): 12386. DOI: 10.1038 / ncomms12386
- Zachariassen, K.E .; Кристиансен, Э. (декабрь 2000 г.). «Зарождение льда и антинуклеация в природе».

 Лед сковывает воды Азова примерно с конца декабря и по начало марта. В некоторых местах толщина ледового покрытия достигает одного метра;
Лед сковывает воды Азова примерно с конца декабря и по начало марта. В некоторых местах толщина ледового покрытия достигает одного метра;